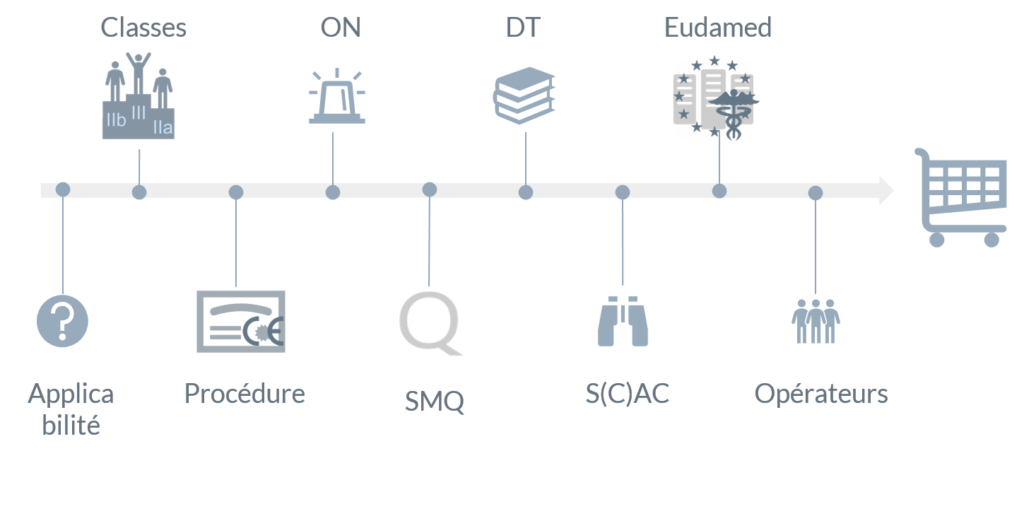
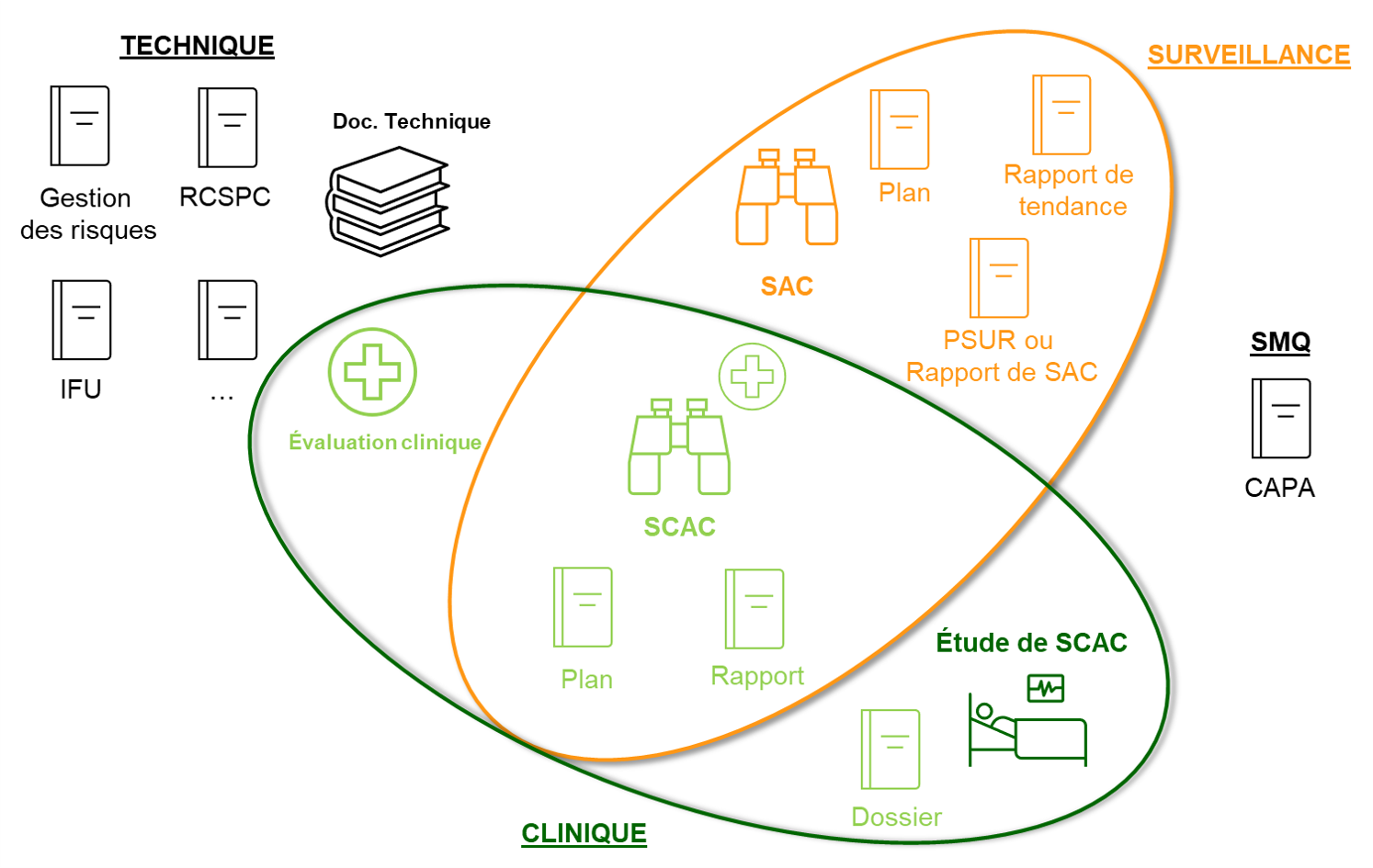
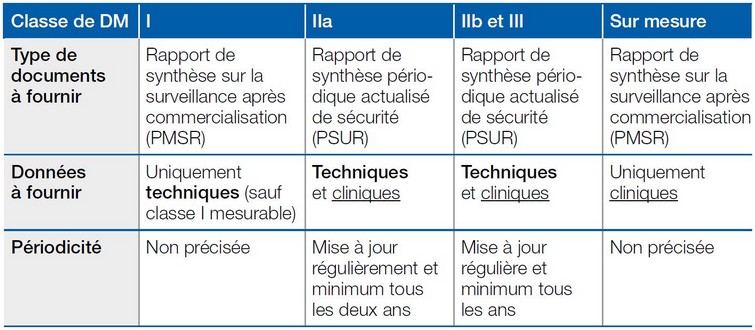
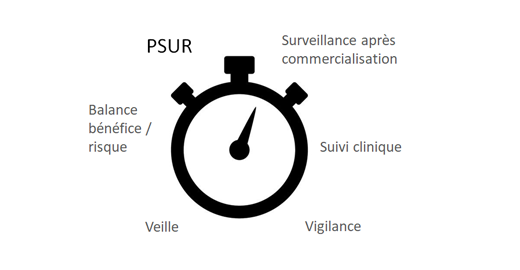
Nouveaux règlements européens pour les dispositifs médicaux - ANSM : Agence nationale de sécurité du médicament et des produits de santé

Inscription pour le webinar sur la présentation du projet de guide MDCG PSUR selon le règlement 2017/745 destiné aux fabricants de dispositifs médicaux - Medicalps

Nouveaux règlements européens pour les dispositifs médicaux - ANSM : Agence nationale de sécurité du médicament et des produits de santé

Master 2 Dispositifs médicaux : de la conception à la commercialisation - Université de Montpellier • Pharm&Cie
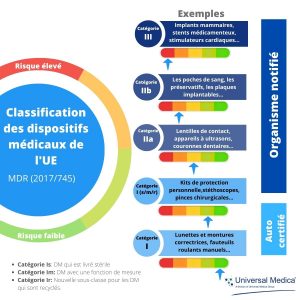
Points clés du nouveau règlement européen sur les dispositifs médicaux (UE) 2017/745. - Universal Medica
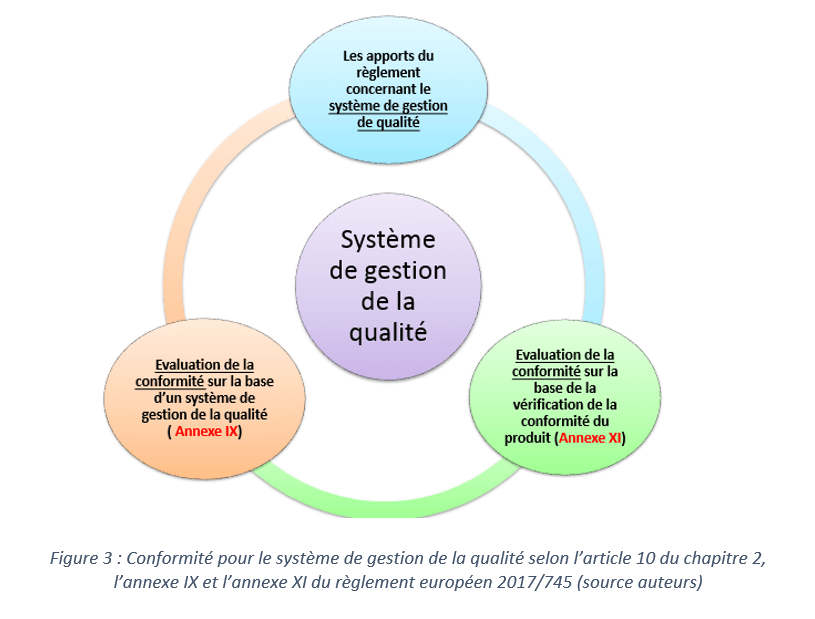
IDS043 - Stratégie de passage au Règlement Européen 2017/745 d'un dispositif médical de classe I déjà commercialisé - Bibliothèque des travaux Master